Nat Med | 大腸がんの腫瘍、免疫、微生物の統合的なランドスケープをマッピングするマルチオミクスアプローチは、マイクロバイオームと免疫システムの相互作用を明らかにする
近年、原発性大腸がんのバイオマーカーは広く研究されているものの、現在の臨床ガイドラインでは、標準的な病理検査に加えて、腫瘍リンパ節転移のステージ分類とDNAミスマッチ修復(MMR)欠損またはマイクロサテライト不安定性(MSI)の検出のみに基づいて治療方針が決定されています。研究者らは、がんゲノムアトラス(TCGA)大腸がんコホートにおける遺伝子発現に基づく免疫応答、微生物プロファイル、および腫瘍間質と患者の生存率との間に関連性が認められないことを指摘しています。
研究が進むにつれて、がん細胞、免疫、間質、微生物の性質を含む原発性大腸がんの量的特性が臨床結果と有意に相関することが報告されていますが、それらの相互作用が患者の結果にどのように影響するかについてはまだ十分に理解されていません。
カタールのシドラ医療研究所の研究チームは、表現型の複雑性と転帰の関係を解明するため、マイクロバイオームの特性と免疫拒絶定数(ICR)を組み合わせることで、生存率の高い患者群を特定する統合スコア(mICRoScore)を最近開発し、検証しました。研究チームは、原発性大腸がん患者348名の新鮮凍結サンプルを用いて、腫瘍および対応する健常大腸組織のRNAシーケンシング、全エクソームシーケンシング、T細胞受容体および16S細菌rRNA遺伝子の深層シーケンシングを含む包括的なゲノム解析を実施しました。さらに、マイクロバイオームの特性をさらに解明するために、腫瘍ゲノムシーケンシングも追加しました。本研究は、「結腸がんの腫瘍、免疫、マイクロバイオームの統合アトラス」としてNature Medicine誌に掲載されました。

Nature Medicineに掲載された論文
AC-ICAMの概要
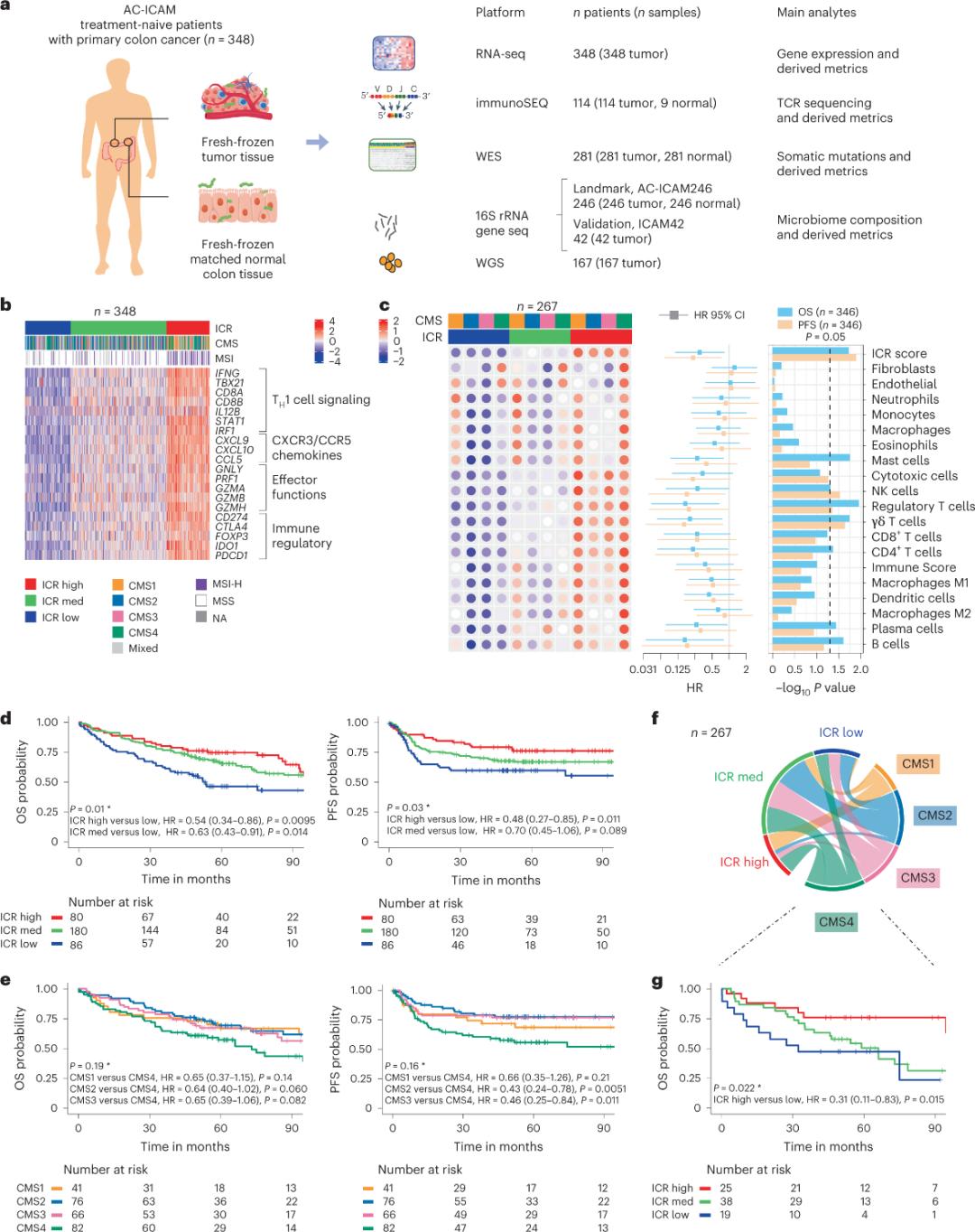
研究者らは、直交ゲノムプラットフォームを用いて、全身療法を受けていない大腸がんの組織学的診断を受けた患者の新鮮凍結腫瘍サンプルと、隣接する健常大腸組織(腫瘍と正常組織のペア)を解析した。全エクソームシーケンス(WES)、RNA-seqデータの品質管理、および包含基準スクリーニングに基づき、348人の患者のゲノムデータを保持し、中央値4.6年間の追跡調査を実施し、下流解析に使用した。研究チームはこのリソースを「Sidra-LUMC AC-ICAM:免疫・がん・マイクロバイオーム相互作用のマップとガイド」(図1)と名付けた。
ICRを用いた分子分類
研究チームは、がんの継続的な免疫監視のための免疫遺伝子マーカーのモジュールセットである拒絶反応定数(ICR)を捕捉し、それを20遺伝子パネルに凝縮することで最適化しました。このパネルは、メラノーマ、膀胱がん、乳がんなど、様々ながん種を網羅しています。ICRは、乳がんを含む様々ながん種における免疫療法への反応とも関連しています。
まず、研究者らはAC-ICAMコホートのICRシグネチャーを検証し、ICR遺伝子に基づく共分類アプローチを用いて、コホートを3つのクラスター/免疫サブタイプ(高ICR(ホット腫瘍)、中ICR、低ICR(コールド腫瘍))に分類しました(図1b)。研究者らは、大腸がんのトランスクリプトームに基づく分類であるコンセンサス分子サブタイプ(CMS)に関連する免疫傾向を特徴付けました。CMSのカテゴリーには、CMS1/免疫、CMS2/標準、CMS3/代謝、CMS4/間葉系が含まれます。解析の結果、ICRスコアはすべてのCMSサブタイプにおいて特定のがん細胞経路と負の相関を示し、免疫抑制および間質関連経路との正の相関はCMS4腫瘍においてのみ観察されました。
すべての CMS において、ナチュラルキラー (NK) 細胞および T 細胞サブセットの豊富さは ICR の高い免疫サブタイプで最も高く、他の白血球サブセットではより大きなばらつきがありました (図 1c)。ICR 免疫サブタイプは OS と PFS が異なり、ICR は低から高へと徐々に増加しました (図 1d)。これは、大腸がんにおける ICR の予後的役割を立証しています。
図 1. AC-ICAM 研究デザイン、免疫関連遺伝子シグネチャー、免疫および分子サブタイプと生存率。
ICRは腫瘍に富み、クローン増幅されたT細胞を捕捉する
腫瘍組織に浸潤するT細胞のうち、腫瘍抗原に特異的なT細胞はごくわずか(10%未満)であると報告されています。そのため、腫瘍内T細胞の大部分はバイスタンダーT細胞と呼ばれます。産生TCRを持つ従来のT細胞の数と最も強い相関が見られたのは、間質細胞と白血球のサブポピュレーション(RNA-seqで検出)であり、これらを用いてT細胞サブポピュレーションを推定できます(図2a)。ICRクラスター(全体およびCMS分類)では、免疫SEQ TCRのクローン性が最も高かったのは、ICR-highおよびCMSサブタイプCMS1/immune群(図2c)であり、ICR-high腫瘍の割合が最も高かったことが示されました。全トランスクリプトーム(18,270遺伝子)を用いた解析では、TCR免疫SEQクローン性と正の相関を示す上位10遺伝子に、6つのICR遺伝子(IFNG、STAT1、IRF1、CCL5、GZMA、CXCL10)が含まれていました(図2d)。ImmunoSEQ TCRクローン性は、腫瘍反応性CD8+マーカーを用いた解析よりも、ほとんどのICR遺伝子とより強い相関を示しました(図2fおよび2g)。結論として、上記の解析は、ICRシグネチャーが腫瘍に富み、クローン的に増幅されたT細胞の存在を捉え、その予後予測における意義を説明できる可能性を示唆しています。
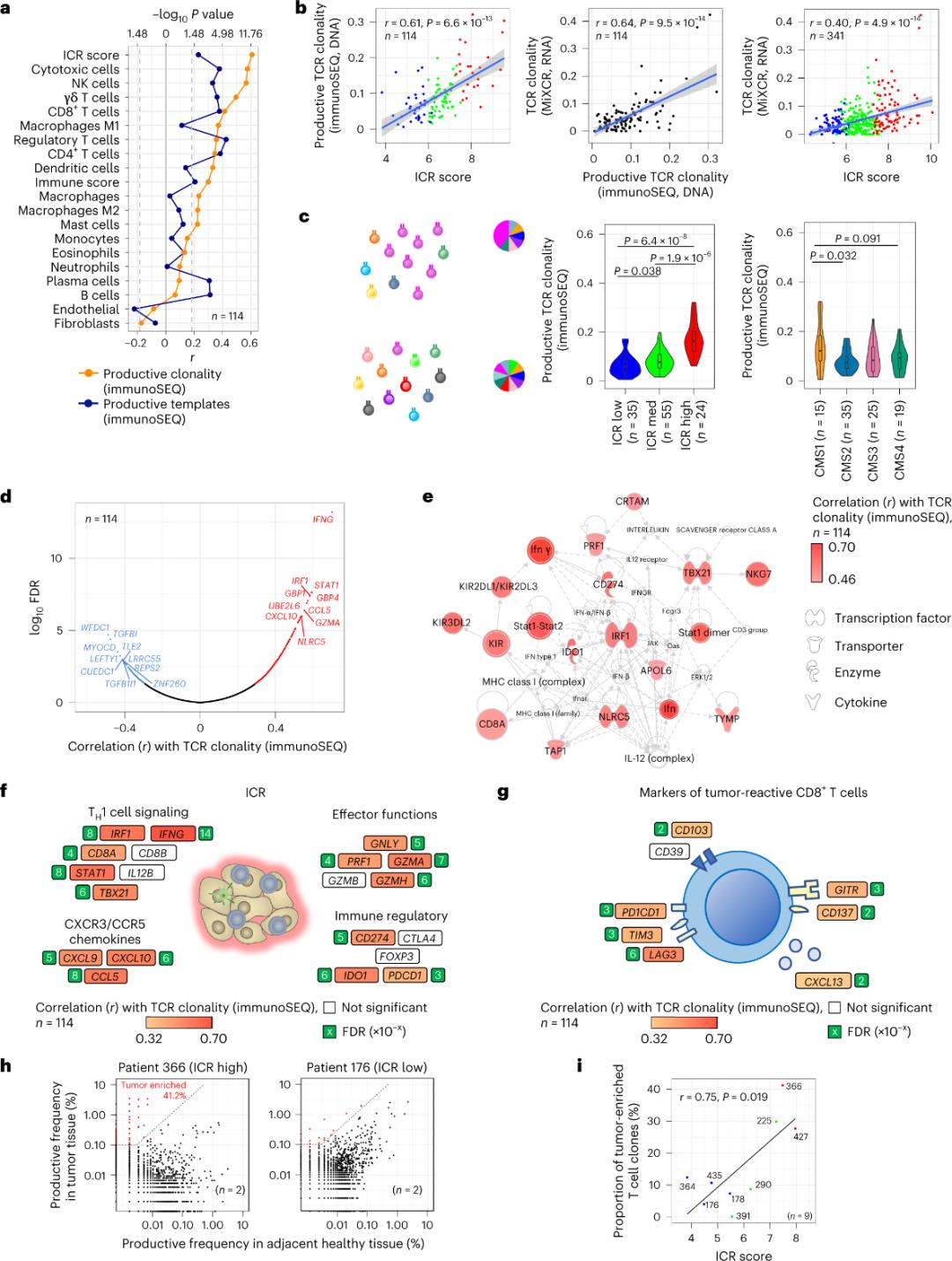
図 2. TCR メトリックおよび免疫関連遺伝子、免疫および分子サブタイプとの相関。
健康組織と大腸がん組織のマイクロバイオーム構成
研究者らは、246人の患者から採取した、対応する腫瘍組織と健常結腸組織から抽出したDNAを用いて16S rRNAシーケンシングを実施した(図3a)。検証のため、解析に使用可能な正常DNAが存在しない42の腫瘍サンプルから得られた16S rRNA遺伝子シーケンシングデータも追加で解析した。まず、対応する腫瘍組織と健常結腸組織における細菌叢の相対的な存在量を比較した。腫瘍組織では、健常サンプルと比較して、ウェルシュ菌(Clostridium perfringens)が有意に増加していた(図3a~3d)。腫瘍組織と健常サンプルのアルファ多様性(単一サンプル中の菌種の多様性と存在量)には有意差は認められず、ICRの高い腫瘍組織では、ICRの低い腫瘍組織と比較して、微生物多様性のわずかな減少が観察された。
微生物プロファイルと臨床転帰との間の臨床的に関連する関連性を検出するため、研究者らは16S rRNA遺伝子配列データを用いて、生存を予測するマイクロバイオーム特性を特定することを目的とした。AC-ICAM246では、研究者らはOS Cox回帰モデルを用いて、MBR分類子と呼ばれる、非ゼロ係数(死亡リスクの差異と関連)を持つ41の特性を選択した(図3f)。
この研修コホート(ICAM246)では、MBRスコアが低いこと(MBR<0、MBRが低いこと)が死亡リスク(85%)の有意な低下と関連していました。研究者らは、独立して検証された2つのコホート(ICAM42およびTCGA-COAD)において、MBRの低さ(リスク)とOSの延長との関連を確認しました。(図3)この研究では、胃内球菌とMBRスコアの間に強い相関が見られ、腫瘍組織と健常結腸組織では両者は同様でした。
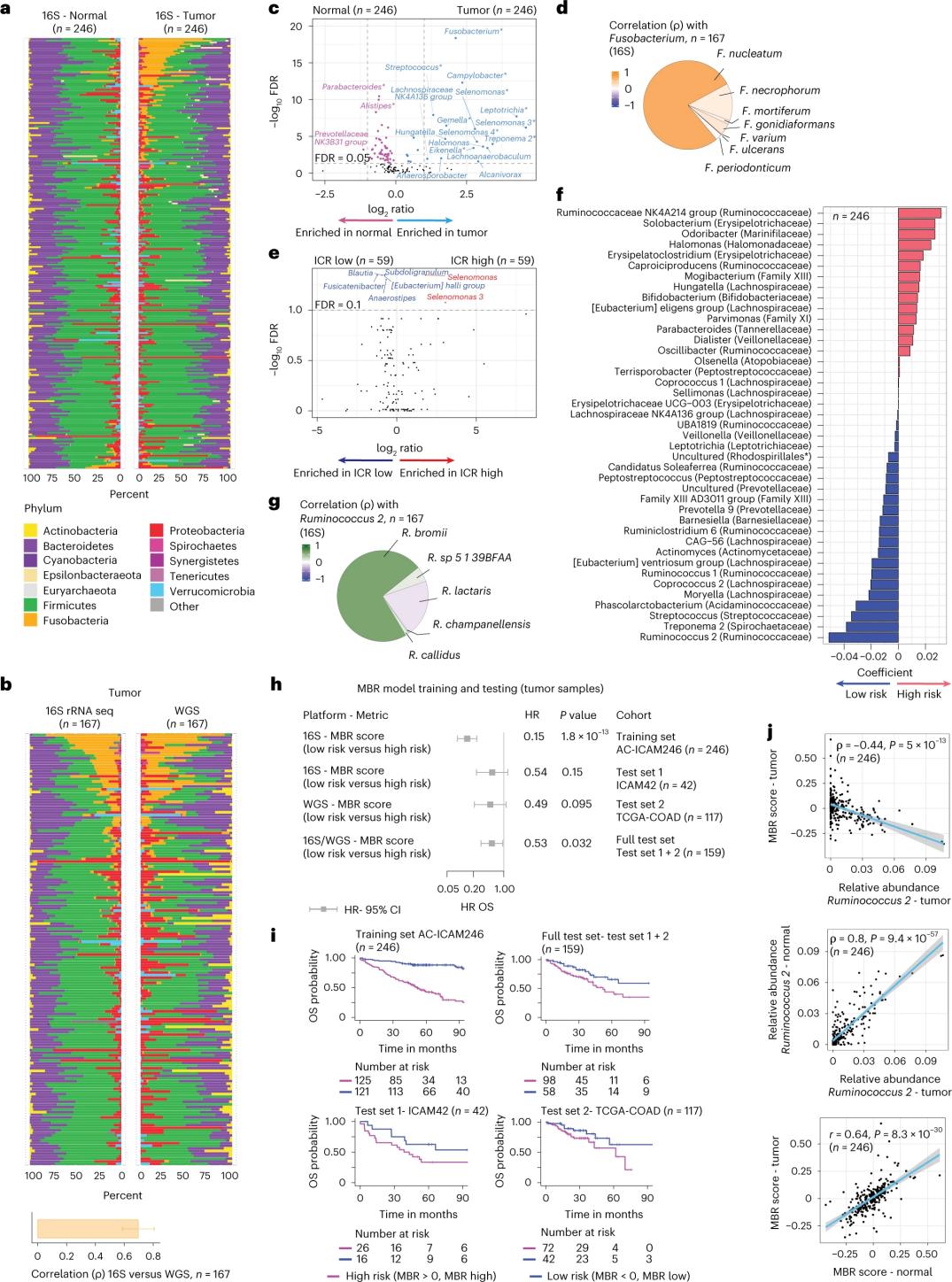
図 3. 腫瘍組織と健常組織のマイクロバイオームと ICR および患者生存率との関係。
結論
本研究で用いられたマルチオミクスアプローチは、大腸がんにおける免疫応答の分子シグネチャーを徹底的に検出・解析することを可能にし、マイクロバイオームと免疫系の相互作用を明らかにしました。腫瘍組織と健常組織のT細胞受容体(TCR)のディープシーケンシングにより、ICRの予後効果は、腫瘍に富み、おそらく腫瘍抗原特異的なT細胞クローンを捕捉する能力によるものであることが明らかになりました。
研究チームは、AC-ICAMサンプルの16S rRNA遺伝子配列を用いて腫瘍マイクロバイオームの構成を解析し、高い予後予測価値を持つマイクロバイオームシグネチャー(MBRリスクスコア)を特定しました。このシグネチャーは腫瘍サンプル由来のものでしたが、健康な大腸と腫瘍MBRリスクスコアの間には強い相関関係が認められ、このシグネチャーが患者の腸内マイクロバイオームの構成を捉えている可能性を示唆しています。ICRスコアとMBRスコアを組み合わせることで、大腸がん患者の生存率を予測するマルチオミクス学生バイオマーカーを特定し、検証することができました。本研究のマルチオミクスデータセットは、大腸がんの生物学的特性をより深く理解し、個別化治療アプローチの発見に役立つリソースを提供します。
参照:
Roelands、J.、Kuppen、PJK、Ahmed、EI 他。結腸がんの腫瘍、免疫、マイクロバイオームの統合アトラス。 Nat Med 29、1273–1286 (2023)。
投稿日時: 2023年6月15日
 中文网站
中文网站